作者简介:邹莉(1966—),女,黑龙江哈尔滨人,教授,主要从事资源微生物方向的研究。E-mail:zouli6616@yahoo.com.cn
以采自内蒙古根河地区的野生花脸香蘑为材料,采用组织分离法分别对其菌盖处、菌盖与菌柄交界处和菌柄处的组织进行分离纯化;通过测定生长速度和污染率等方法,研究分离纯化的最适培养基和最佳部位;最后将分离物进行ITS序列分析,计算遗传距离,并采用邻接法构建NJ系统发育树。结果表明,分离纯化最适培养基为PDA+子实体煮水培养基;菌盖与菌柄交界处为最佳分离部位,菌丝生长速度快、长势好、污染率低;并且子实体经自然风干2 d后能有效降低污染率;最后分离物经ITS序列测定,系统发育分析证实其为花脸香蘑。
Lepista sordida which was collected from Genhe District in Inner Mongolia was used as materials, tissue isolation was used to isolate the tissue of pileus, stipe, and junction of them. The optimal culture medium and the best tissue for isolation was investigated by measuring growth rate and pollution rate. Then the isolate was identified by internal transcribed spacer (ITS), the genetic distance was calculated by Kimura2-parame-ter, and a NJ systematic tree was established by the neighbor-joining method. The results showed that the optimal culture medium was PDA added with sporocarp boiled water, and the junction of pileus and stipe showed fast growth and low pollution, which was the best isolation position. Moreover, the pollution rate could be effectively reduced when the sporocarp had been air-dried for 2 days. At last, the isolate was identified as Lepista sordida by the analysis of phylogenetic relationship of ITS gene sequences.
花脸香蘑(Lepista sordida)又叫紫晶香磨、丁香蘑等, 属真菌界(Fungi)担子菌门(Basidiomycomycota)层菌纲(Hymenomycetes)伞菌目(Agaricales)口磨科(Tricholomataceae)香蘑属(Lepista)[1]。子实体中等大小, 菌盖直径2.0~10.5(12)cm, 紫色、浅红菱色或藕粉色, 菌肉薄并带淡紫色, 菌褶淡蓝紫色或浅红菱色[2, 3]。花脸香蘑含有丰富的蛋白质和氨基酸, 还富含钙、铁、锌、硒等微量元素[4], 其菌株发酵物有较强的抗癌、抗菌等活性[5], 是营养价值与药用价值兼优的野生食用菌, 具有极大的开发价值[6]。目前, 对于花脸香蘑的研究报道不多, 主要是关于其发酵物[7]、提取物[8]以及生长特性[9]的研究, 而关于花脸香蘑人工栽培方面的研究较少。本研究以采自内蒙古根河地区的野生花脸香蘑为实验材料, 通过组织分离法对其进行菌种分离纯化以及ITS序列测定, 以期为花脸香蘑的进一步开发与利用提供科学依据。
花脸香蘑(Lepista sordida), 2013年9月采自内蒙古根河地区。
1.2.1 培养基的制备
本试验共设4种培养基, 基础培养基为PDA培养基, 碳源为葡萄糖, 其他培养基分别添加前人研究的最适氮源和无机盐等作为比较。
培养基①:PDA培养基。马铃薯200 g, 葡萄糖20 g, 琼脂15~20 g, 水1 000 mL。将马铃薯切成1 cm× 1 cm× 1 cm小块放于锅中加水煮20~30 min, 过滤取滤液, 加入葡萄糖与琼脂煮沸4~5 min, 分装于三角瓶中, 灭菌。灭菌采用高压蒸汽灭菌, 121 ℃灭菌20 min。
培养基②:PDA+酵母膏培养基。在1 L PDA培养基中加入3 g酵母膏[10]配制而成。
培养基③:PDA+无机盐培养基。在1 L PDA培养基中加入0.5 g MgSO4, 1 g KH2P
培养基④:PDA+子实体煮水培养基。采集的花脸香蘑子实体经水煮后的滤液代替水配制而成。
1.2.2 子实体不同部位对分离的影响
将解剖刀、接种钩、封口膜以及PDA平板于超净工作台中开紫外灭菌30 min。将花脸香蘑新鲜子实体用75%乙醇擦拭2~3遍, 用无菌的解剖刀在菌盖中央划口, 用手轻轻掰开, 注意不要用手接触到内部的菌肉。用无菌的接种钩分别在子实体菌盖、菌盖与菌柄交界处和菌柄处取一小块菌肉, 将其迅速放置于事先灭好菌的PDA平板培养基中, 每个培养皿接1块菌肉, 重复20组, 用封口膜进行封口后置于25 ℃恒温培养箱中进行培养, 每天观察长势并记录[12]。
花脸香蘑菌丝生长速度的测定采用十字划线法[13]。将菌肉接于培养皿中心位置, 在平板底部用记号笔画上两条经过中心点的垂直线, 每天同一时间测量菌落的直径, 计算菌丝生长速度(mm· d-1)。
1.2.3 子实体风干程度对污染率的影响
分别对新鲜的子实体和经自然风干1, 2, 3 d的子实体进行分离纯化, 从上述试验选出的最佳分离部位处取菌肉接于PDA平板培养基中, 每个平板中放置1块菌肉, 重复20组, 于25 ℃恒温培养箱中进行培养, 观察污染情况并记录。
1.2.4 不同培养基对分离的影响
分别制备1.2.1节中的4种培养基, 对花脸香蘑进行分离培养。从上述试验选出最佳风干程度的子实体并从最佳分离部位处取菌肉接于4种培养基中, 每个平板放置1块菌肉, 重复20组, 于25 ℃恒温培养箱中进行培养, 观察菌丝长势并记录。
1.2.5 DNA的提取、扩增和鉴定
采用快捷型植物基因组 DNA 提取试剂盒(天根)分别对花脸香蘑的子实体和分离培养得到的菌丝体进行基因组 DNA 的提取。子实体用无菌的接种钩钩取其纯净的菌肉, 放于研钵中, 加入液氮充分研磨; 菌丝体用无菌的小勺在分离培养基上刮取后放于研钵中, 加入液氮充分研磨。其余步骤参照说明书。
采用通用引物ITS1和ITS4(ITS1:5’ -TCCGTAGGT-GAACCTGCGG-3’ ; ITS4:5’ -TCCTCCGCT-
TATTGATATGC-3’ )用于rDNA ITS 区段的 PCR 扩增[14]。扩增体系为50 μ L, 其中去离子水为35.5 μ L, 10× PCR缓冲液 5 μ L, dNTPs(2.5 mmol· L-1)4 μ L, ITS1 /ITS4 引物各2 μ L, Taq DNA 酶(5 U· μ L-1)0.5 μ L, 模板DNA 1 μ L(浓度20~50 ng· μ L-1); PCR反应条件:95 ℃预变性5 min, 94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸40 s, 35个循环; 72 ℃反应7 min。对PCR扩增产物进行电泳检测后送至哈尔滨博仕公司进行测序。
将测序结果在NCBI中做BLASTN比对, 找出并下载> 95%相似性序列, 用ClustalX2.1的Alignment程序对所有同源序列进行多重对位排列。用MEGA 5.02软件包进行系统发育分析和进化树的构建。用Kimura2-parame-ter 模式计算遗传距离, 所有对位排列结果中的空位(gaps)或缺失数据(missing data)作完全删除(complete deletion)处理, 进化距离分析采用邻位相连法(neighbor-joining, NJ)。系统树的每个分支的统计学显著性分析以自展法(bootstrap)进行检验, 重复次数为1 000次。
从表1可以看出, 从花脸香蘑子实体的不同部位所取菌肉组织经培养后, 3个部位的菌丝生长速度有极显著差异, 其中菌盖与菌柄交界处菌丝长势最旺盛, 生长速度最快, 且污染率最低, 都显著低于其他2个部位的平均污染率。因此, 菌盖与菌柄交界处为最佳分离部位。
| 表1 子实体不同部位对分离的影响 Table 1 Effect of sporocarp different parts on isolation |
通过前一组试验确定菌盖与菌柄交界处为最佳分离部位, 本组试验以新鲜的花脸香蘑子实体和经自然风干1, 2, 3 d的子实体为材料, 同时取菌盖与菌柄交界处的菌肉进行培养, 研究子实体风干程度对污染率的影响。
试验结果表明, 风干2 d子实体菌盖与菌柄交界处的平均污染率(11.53%)要显著低于新鲜子实体的污染率(16.19%)和风干3 d子实体的污染率(15.04%), 但与风干1 d子实体的污染率(14.78%)差异不显著。因此, 采用风干2 d的花脸香蘑子实体进行分离能有效地降低污染率。
通过前两组试验确定了最佳分离部位以及子实体最佳风干程度, 本组试验分别采用4种培养基对风干2 d的花脸香蘑子实体取其菌盖与菌柄交界处的菌肉进行培养, 研究不同培养基对分离的影响。
结果表明, 采用培养基①的菌丝生长速度为7.8 mm· d-1, 采用培养基②的菌丝生长速度为8.5 mm· d-1, 采用培养基③的菌丝生长速度为8.1 mm· d-1, 采用培养基④的菌丝生长速度为8.8 mm· d-1。
对4种培养基的菌丝生长速度进行比较发现, 采用添加了无机盐的培养基③培养后对菌丝的生长速度提升并不显著, 而用培养基②和培养基④进行分离培养后, 菌丝生长速度均显著高于另外2种培养基的菌丝生长速度, 且培养基④菌丝生长速度提升最大。因此, PDA+子实体煮水培养基最适合花脸香蘑的生长。
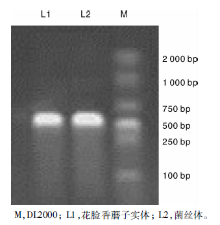
对花脸香蘑子实体及分离培养得到的菌丝进行DNA提取并以提取的DNA为模板进行PCR扩增, PCR产物经1%琼脂糖凝胶电泳检测后得到如图1所示的特异性条带。由图1可以看出, L1与L2片段大小一致, 约为670 bp左右, 与测序得到的基因片段长度L1 677 bp和L2 674 bp大小相符, 并且L1与L2有99%的同源性。因此, 可以初步判定菌丝体L2为花脸香蘑子实体L1的纯培养菌株。
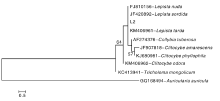
在NCBI中进行BLASTN比对, 找到8条与L2相似性> 95%的序列并下载, 用ClustalX 2.1软件进行序列比对, 并辅以人工修正。基于来自NCBI中的8个种的ITS序列, 以木耳(Auricularia auricula)作为外参, 连同试验中的 ITS 序列共10个序列一起用于系统发育分析。用MEGA 5.02中的邻接法(NJ)构建系统树。从图2可以看出, L2与香蘑属的Lepista nuda、Lepista sordida和Lepista tarda有较近的系统发育关系, 与近缘属的Clitocybe odora和Tricholoma mongolicum序列差异较大, 系统发育关系较远。
本试验采用组织分离法对野生花脸香蘑进行分离, 试验结果表明, 野生花脸香蘑能够成功分离并且菌盖与菌柄交界处为最佳分离部位, 其菌丝长势好, 生长速度快并且污染率低, 可能是因为该部位与空气接触少, 杂菌少, 因而培养时污染率低; 另外, 本试验筛选出最适宜分离的培养基为PDA+子实体煮水培养基, 用此培养基进行组织分离能提高菌丝生长速度, 原因可能是子实体煮水后含有菌丝生长所需的营养物质和微量元素; 并且将子实体经自然风干2 d后再进行分离能有效地降低污染率, 这可能是因为将子实体风干后能减少杂菌尤其是细菌的数量, 从而降低污染率, 但风干时间过长也可能进一步导致杂菌滋生, 因而风干时间以2 d为最佳。
本试验关于菌种鉴定采用ITS法, 其准确性高且简单易行。通过对供试子实体与菌丝体的ITS区段长度进行比对, 验证了供试菌丝体为花脸香蘑的分离物; 构建系统发育树后验证供试菌丝体与香蘑属的Lepista nuda, Lepista sordida和Lepista tarda有较近的系统发育关系。本试验成功分离了野生花脸香蘑, 并验证其供试菌丝体为花脸香蘑, 为花脸香蘑的进一步开发利用提供了科学依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|